把一定量的二氧化碳通入氫氧化鈉溶液中,恰好完全反應后,得到碳酸鈉溶液11.1克,把溶液蒸干后得到2.6 5克純凈的無水碳酸鈉.求:
(1)氫氧化鈉溶液中溶質的質量分數.
(2)若將上述氫氧化鈉溶液與30克10%的氫氧化鈉溶液混合,求混合后溶液中溶質的質量分數.
【答案】
分析:(1)根據發(fā)生的反應的化學方程式結合碳酸鈉的質量可以計算出氫氧化鈉的質量,進而求得氫氧化鈉溶液中溶質的質量分數;
(2)根據混合后溶質的質量不變結合溶質的質量分數的計算公式來完成該題的解得.
解答:解:設參加反應的二氧化碳的質量為x,氫氧化鈉的質量為y
2NaOH+CO
2═Na
2CO
3+H
2O
80 44 106
y x 2.65g
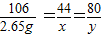
解得:x=1.1g;y=2g;
(1)根據質量守恒定律可以知道,氫氧化鈉溶液的質量為:11.1g-1.1g=10g
所以氫氧化鈉溶液中溶質的質量分數為:
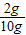
×100%=20%;
(2)由于混合后氫氧化鈉的總質量不變,所以可以得出氫氧化鈉的質量為:
2g+30g×10%=5g
所以混合后溶液中溶質的質量分數為:
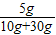
×100%=12.5%.
答:(1)氫氧化鈉溶液中溶質的質量分數20%;
(2)混合后溶液中溶質的質量分數為12.5%.
點評:通過解此類題時,要能夠靈活的應用質量守恒定律,以及根據題中的數據找出等量關系解答.

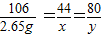
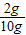 ×100%=20%;
×100%=20%;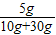 ×100%=12.5%.
×100%=12.5%.
