
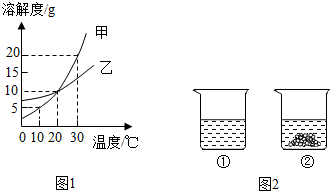
分析 (1)溶解度曲線的交點表示該溫度下,物質的溶解度相等;
(2)根據甲的溶解度可以判斷飽和溶液中溶質與溶劑的質量比;
(3)甲的溶解度隨著溫度的升高而增大,且變化較大,乙的溶解度受溫度影響沒有甲明顯;
(4)根據實驗現象可以判斷相關方面的問題.
解答 解:(1)20℃時,甲乙的溶解度曲線交于一點,二者的溶解度相同;
(3)10℃時甲的溶解度是5g,即100g水中最多溶解5g的甲,所以向50g水中加入5g甲,充分溶解,最多溶解2.5g的甲,所得溶液中溶質與溶劑的質量比為 2.5g:50g=1:20;
(3)30℃時,甲的飽和溶液中含有少量的乙,現要提純甲,可采用降溫結晶或冷卻熱飽和溶液的方法,因為甲的溶解度變化比乙大;
(4)30℃時,向分別盛有相同質量的甲、乙的燒杯中,各加入100g水,充分溶解后,由圖示可知①中溶質全部溶解,而②中有剩余晶體,說明該溫度下①的溶解度大于②,則①是甲的溶解度曲線,②是乙的溶解度曲線;
A、由圖示可知①中溶質全部溶解,全部溶解可能剛好飽和,也可能不飽和,所以A錯誤;
B、乙的溶解度隨溫度升高而增大,所以使燒杯②中固體全部溶解,可以采用升高溫度或增加溶劑的方法,正確;
C、將燒杯②中的溶液變為不飽和溶液,可用加溶劑和升溫的方法,若用升溫至恰好飽和的方法,溶液中的溶質、溶劑質量不變,溶質質量分數不變,故錯誤;
D、由圖示可知②中有剩余晶體,說明該溫度下加入的固體的質量一定大于30℃時乙的溶解度,若將得到的①燒杯中溶液降溫至0℃時,甲的溶解度大大降低,小于降溫前乙 的溶解度,則一定析出晶體,溶液質量分數一定會減少,正確;
故答案為:(1)20℃;(2)1:20;(3)降溫結晶(或冷卻熱飽和溶液);(4)BD.
點評 此題是對溶解度知識的考查,解決的關鍵是利用溶解度的知識對溶液進行分析,并利用降溫使溶質析出的相關知識進行解題的探討.


 特高級教師點撥系列答案
特高級教師點撥系列答案科目:初中化學 來源: 題型:解答題
| 小紅 | 小明 | |
| A | 甲:氯化鋇 乙:稀鹽酸 | 甲:硝酸鋇 乙:稀硝酸 |
| B | 甲:硝酸鋇 乙:稀硝酸 | 甲:氯化鋇 乙:稀鹽酸 |
| C | 甲:硝酸鋇 乙:稀鹽酸 | 甲:氯化鋇 乙:稀硝酸 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | Ca(OH)2、NaOH和H2 | B. | CaCO3、Ca(OH)2、NaOH和H2 | ||
| C. | CaCO3、NaOH、Ca(OH)2 | D. | Ca(OH)2、CaCO3和H2 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 實驗老師買來一瓶濃硫酸,仔細觀察標簽,其內容如圖所示,請回答下列問題:
實驗老師買來一瓶濃硫酸,仔細觀察標簽,其內容如圖所示,請回答下列問題:查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題

查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
 實驗室現有一種含有氯化鈉的純堿固體樣品.某化學興趣小組的同學在老師的指導下,利用如圖所示裝置(部分固定裝置已略去)進行實驗,測定其中純堿的含量,并證實二氧化碳能與氫氧化鈉發生化學反應.已知,該裝置氣密性良好,氫氧化鈉溶液過量.
實驗室現有一種含有氯化鈉的純堿固體樣品.某化學興趣小組的同學在老師的指導下,利用如圖所示裝置(部分固定裝置已略去)進行實驗,測定其中純堿的含量,并證實二氧化碳能與氫氧化鈉發生化學反應.已知,該裝置氣密性良好,氫氧化鈉溶液過量.查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com