某同學在做鐵與硫酸銅溶液反應的實驗時,發現生成銅的同時有氣泡產生.他們懷疑硫酸銅溶液不純,為了證實猜想,做了如下實驗:
a.取8.5g鐵粉放入100g的硫酸銅溶液中,反應完成后,濾出固體,洗滌、干燥后稱量,固體質量為9.2g.
b.將9.2g固體與足量的稀硫酸充分反應后,反應所產生氫氣的質量為0.1g,則固體質量減少了______g;
計算:
(1)硫酸銅溶液中溶質質量分數;
(2)上述實驗中鐵與硫酸銅溶液和稀硫酸反應的總質量______g,對次結果請你作出解釋______.
【答案】
分析:b、利用鐵與稀硫酸反應的化學方程式,根據氫氣的質量求出鐵的質量,即為固體減少的質量.
(1)9.2g固體能與稀硫酸發生反應,說明9.2g固體不全是銅,還有鐵,用9.2g-固體中混有的鐵的質量=銅的質量.利用鐵與硫酸銅反應的化學方程式,根據銅的質量求常見反應的硫酸銅的質量;再根據硫酸銅溶液的質量即可求得硫酸銅溶液中溶質質量分數;
(2)在做鐵與硫酸銅溶液反應的實驗時,發現生成銅的同時有氣泡產生.說明硫酸銅溶液中混有酸,部分鐵與硫酸銅溶液中的酸發生反應,所以會造成與硫酸銅反應的鐵的質量及與稀硫酸反應的鐵的質量之和小于8.5g.
解答:解:b、設9.2g固體與足量的稀硫酸反應的鐵的質量為x
Fe+H
2SO
4=FeSO
4+H
2↑
56 2
x 0.1g

=

解得:x=2.8g;
則固體質量減少了2.8g.
故答案為:2.8.
(1)9.2g固體中銅的質量為:9.2g-2.8g=6.4g
設與鐵反應的硫酸銅的質量為y,鐵的質量為z
Fe+CuSO
4=FeSO
4+Cu
56 160 64
z y 6.4g

=
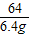
,

=

;
解得:y=16g,z=5.6g;
則硫酸銅溶液中溶質質量分數為

×100%=16%;
答:硫酸銅溶液中溶質質量分數為16%.
(2)由上面的解答可知:與稀硫酸反應的鐵的質量為2.8g,與硫酸銅反應的鐵的質量為5.6g;
則鐵與硫酸銅溶液和稀硫酸反應的總質量為:2.8g+5.6g=8.4g<8.5g;
因為有少量鐵與硫酸銅溶液中的酸性物質反應生成了氣體.
故答案為:小于8.5或為8.4;因為有少量鐵與硫酸銅溶液中的酸性物質反應生成了氣體.
點評:做硫酸銅與鐵反應的實驗時,生成的銅覆蓋在鐵的表面,會造成鐵不能完全反應,所以將生成的銅放入硫酸中會有氣體生成,那其實是未反應的鐵在與稀硫酸發生反應.

 =
=
 =
=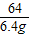 ,
, =
= ;
; ×100%=16%;
×100%=16%;
