向Na2CO3溶液里滴加鹽酸,開始時無氣泡產生,后來才有氣泡產生;向鹽酸里滴加Na2CO3溶液時,立即有氣泡產生,這說明( )
A.Na2CO3過量時,主要發生的反應是Na2CO3+HCl═NaHCO3+NaCl
B.Na2CO3跟鹽酸不反應
C.鹽酸過量時,主要發生的反應是Na2CO3+2HCl═H2O+2NaCl+CO2↑
D.產生的氣泡是揮發出來的氯化氫氣體
【答案】分析:向碳酸鈉溶液中滴加鹽酸,鹽酸少量,反應方程式為Na2CO3+HCl═NaHCO3+NaCl,沒有二氧化碳生成.
當向鹽酸中滴加Na2CO3溶液時,鹽酸過量,發生反應Na2CO3+2HCl═H2O+2NaCl+CO2↑,立即有CO2氣體產生.
解答:解:A、向碳酸鈉溶液中滴加鹽酸,鹽酸少量,反應方程式為Na2CO3+HCl═NaHCO3+NaCl,沒有二氧化碳生成.
當碳酸鈉全部轉換為碳酸氫鈉時繼續加鹽酸發生反應NaHCO3+HCl=NaCl+CO2↑+H2O,有CO2氣體放出.所以A正確.
B、Na2CO3跟鹽酸可以反應放出二氧化碳.Na2CO3+2HCl═H2O+2NaCl+CO2↑所以B 不正確.
C、當向鹽酸中滴加Na2CO3溶液時,鹽酸過量,發生反應Na2CO3+2HCl═H2O+2NaCl+CO2↑,立即有CO2氣體產生.
所以C正確.
D、鹽酸揮發是在溶液表面發生的,不會產生氣泡.所以D不正確.
故選AC
點評:本題重點考查了Na2CO3和與NaHCO3與鹽酸反應不同現象,并對Na2CO3和HCl過量性反應進行探究.



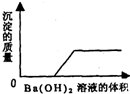 (1)某一由鹽酸、碳酸鈉溶液、稀硫酸、氯化銅溶液四種物質中的兩種混合形成的混合溶液,現向該混合溶液中滴入氫氧化鋇溶液,產生沉淀的質量與加入氫氧化鋇溶液體積的關系如圖所示.該混合溶液的組成是
(1)某一由鹽酸、碳酸鈉溶液、稀硫酸、氯化銅溶液四種物質中的兩種混合形成的混合溶液,現向該混合溶液中滴入氫氧化鋇溶液,產生沉淀的質量與加入氫氧化鋇溶液體積的關系如圖所示.該混合溶液的組成是