BC
分析:A、氫氧化鈣的溶解度隨溫度的升高而減小;
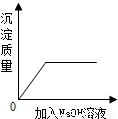
B、根據金屬和鹽反應的方程式,利用差量法進行分析;
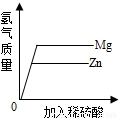
C、等質量的金屬與足量的酸反應,則金屬全部參加反應,生成氫氣的質量等于

產生氫氣的速率與金屬的活動性有關;
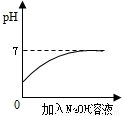
D、根據酸堿的PH范圍判斷.
解答:A、氫氧化鈣的溶解度隨溫度的升高而減小,而不是逐漸增大,故錯誤;
B、鐵與硝酸銀反應生成銀和硝酸亞鐵,方程式是:Fe+2AgNO
3═2Ag+Fe(NO
3)
2固體質量△m
56 216 216-56=160
由此可知,隨著反應的進行,固體質量逐漸增加,則溶液質量逐漸減小,當鐵片反應完,則質量不再變化,坐標圖正確;
C、等質量Mg、Zn加入足量的稀鹽酸,鎂反應的速率大于鋅,表現在坐標中斜線較陡,等質量的金屬與足量的酸反應,則金屬全部參加反應,生成氫氣的質量等于

,鎂和鋅都是+2價,金屬的質量相等,鎂的相對原子質量小于鋅的相對原子質量,則鎂生成的氫氣質量大于鋅生成的氫氣的質量,故正確;
D、該反應是中和反應,橫坐標是鹽酸的體積,則是將鹽酸滴加到堿液中,則溶液的起始pH>7,而非小于7,故錯誤;
故選BC.
點評:此題是對化學反應及圖象的考查,解題的重點是能正確的分析變化的過程,讀懂圖象并與反應相結合是解題的關鍵所在,是一道訓練學生分析問題能力很好的習題.





 產生氫氣的速率與金屬的活動性有關;
產生氫氣的速率與金屬的活動性有關; ,鎂和鋅都是+2價,金屬的質量相等,鎂的相對原子質量小于鋅的相對原子質量,則鎂生成的氫氣質量大于鋅生成的氫氣的質量,故正確;
,鎂和鋅都是+2價,金屬的質量相等,鎂的相對原子質量小于鋅的相對原子質量,則鎂生成的氫氣質量大于鋅生成的氫氣的質量,故正確;

 智慧小復習系列答案
智慧小復習系列答案