
| 物質 | 第一次 | 第二次 | 第三次 |
| 加入稀硫酸質量(g) | 60.0 | 60.0 | 60.0 |
| 剩余固體的質量(g) | 6.8 | 3.6 | 2.0 |
分析 (1)根據赤鐵礦的主要成分為氧化鐵,氧化鐵與硫酸可發生復分解反應,通過交換成分可形成硫酸鐵和水進行分析;
(2)根據表中信息,每60g稀硫酸消耗氧化鐵質量為6.8g-3.6g=3.2g,利用反應的化學方程式,可由氧化鐵質量計算出硫酸的質量進行分析;
(3)根據稀釋溶液時溶質質量不變解答;
(4)根據表中信息,每60g稀硫酸消耗氧化鐵質量為6.8g-3.6g=3.2g,第三次60g稀硫酸消耗氧化鐵質量為3.6g-2g=1.6g,2g為雜質質量,共消耗稀硫酸的質量為60g+60g+30g=150g,氧化鐵質量3.2g×2+1.6g=8g,計算出生成的氯化鐵的質量,根據溶質的質量分數計算公式即可解得;
(5)根據反應中鐵元素的質量守恒來解答.
解答 解:(1)赤鐵礦的主要成分為三氧化二鐵,三氧化二鐵與硫酸反應生成硫酸鐵和水,化學方程式為:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)根據表中信息,每60g稀硫酸消耗氧化鐵質量為6.8g-3.6g=3.2g,設第二次消耗稀硫酸溶質質量為x
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
160 294
3.2g x
$\frac{160}{294}$=$\frac{3.2g}{x}$
x=5.88g
稀硫酸的溶質質量分數為:$\frac{5.88g}{60g}$×100%=9.8%,
(3)需要加入水的質量是:200g-$\frac{200g×9.8%}{98%}$=180g;
(4)根據表中信息,每60g稀硫酸消耗氧化鐵質量為6.8g-3.6g=3.2g,第三次60g稀硫酸消耗氧化鐵質量為3.6g-2g=1.6g,2g為雜質質量,共消耗稀硫酸的質量為60g+60g+30g=150g,氧化鐵質量3.2g×2+1.6g=8g,生成的氯化鐵的質量為y
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
160 406
8g y
$\frac{160}{8g}$=$\frac{406}{y}$
y=20.3g
最終所得的溶液的質量為:8g+150g+42g=200g
則最終所得的溶液中溶質的質量分數是:$\frac{20.3g}{200g}$×100%=10.15%;
(5)根據表中信息可知,氧化鐵質量3.2g×2+1.6g=8g,赤鐵礦樣品的質量為6.8g+3.2g=10g,根據反應中鐵元素的質量守恒,10g赤鐵礦樣品中鐵元素的質量為:8g×$\frac{56×2}{56×2+16×3}$×100%=5.6g
100t該礦石可制得鐵的質量為:150t×$\frac{5.6g}{10g}$=84t,$\frac{84t}{1-4%}$=87.5t.
故答案為:(1)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)$\frac{294}{160}$=$\frac{x}{3.2g}$;
(3)180;
(4)10%;
(5)87.5t.
點評 這是一道常見的化學綜合計算題.解題的關鍵在于弄清化學反應中反應物、生成物之間的關系,同時要弄清雜質在反應中存在于什么地方.第二問中關于反應后溶液中溶質的質量分數的計算,關鍵是要弄清反應后溶液是什么溶液.


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:初中化學 來源: 題型:選擇題
| A. | 青蒿素中氧元素質量分數為12% | B. | 青蒿素中碳、氧元素質量比為3:1 | ||
| C. | 青蒿素屬于氧化物 | D. | 一個青蒿素分子中含有42個原子 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 常溫下,過氧化氫溶液極易分解產生氧氣 | |
| B. | 檢驗氧氣是否集滿的方法是用帶火星的木條伸入集氣瓶中 | |
| C. | 水的天然循環主要是通過物理變化完成的 | |
| D. | 原子是不可再分的 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
 2014年10月22日,2014年哈爾濱市重點工程:南崗區龍葵路跨線橋工程完成混凝土澆注.該橋建成后市民可從南崗區直線到達道里區.下列有關說法不正確的是( )
2014年10月22日,2014年哈爾濱市重點工程:南崗區龍葵路跨線橋工程完成混凝土澆注.該橋建成后市民可從南崗區直線到達道里區.下列有關說法不正確的是( )| A. | 該橋建成后,將會極大地緩解哈西地區的交通壓力 | |
| B. | 建橋時用了大量的水泥和鋼筋混凝土等金屬材料 | |
| C. | 該橋兩側的欄桿刷油漆的主要目的是為了防銹 | |
| D. | 寬闊的柏油橋面所用的瀝青是石油煉制的產品 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
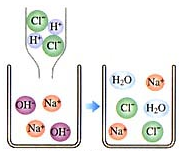 如圖為某化學反應的微觀模擬圖,根據模擬圖回答:
如圖為某化學反應的微觀模擬圖,根據模擬圖回答:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
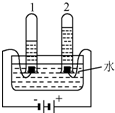 今年3月22-28日是第28屆“中國水周”,其主題為“節約水資源,保障水安全.”
今年3月22-28日是第28屆“中國水周”,其主題為“節約水資源,保障水安全.”查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com