
 實驗室常用加熱(85℃)NH4Cl和NaNO2兩種飽和溶液的方法制取N2,如圖是實驗室用這種方法制N2,并測定生成N2體積的裝置(部分裝置略去),請回答相關問題:
實驗室常用加熱(85℃)NH4Cl和NaNO2兩種飽和溶液的方法制取N2,如圖是實驗室用這種方法制N2,并測定生成N2體積的裝置(部分裝置略去),請回答相關問題:
| ||
| 37g |
| 100g+37g |
| ||
| 53.5 |
| 28 |
| 0.21g |
| x |
| 0.11g |
| 1.25g?L-1 |
| ||


科目:初中化學 來源: 題型:閱讀理解
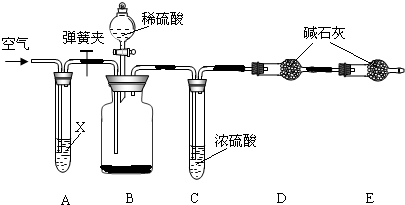
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:初中化學 來源:2013-2014學年江蘇省揚州市江都區九年級上期末考試化學試卷(解析版) 題型:探究題
實驗室常用加熱(85℃)NH4Cl和NaNO2兩種飽和溶液的方法制取N2,下圖是實驗室用這種方法制N2,并測定生成N2體積的裝置(部分裝置略去),請回答相關問題:
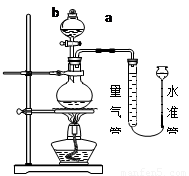
【查閱資料】:
1、NH4Cl和NaNO2反應生成NaCl、H2O及N2,并放出大量熱量;
2、20℃時,NH4Cl的溶解度約為37g;
3、N2難溶于水,實驗條件下,密度為1.25g·L—1。
【實驗步驟】:
① ;
②20℃時,取0.78g飽和NH4Cl溶液放入燒瓶,連接裝置;
③調節水準管,使其與量氣管中液面相平,記錄量氣管中水面讀數為12mL;
④打開分液漏斗活塞,逐滴滴入飽和NaNO2溶液,加熱至反應發生,移走酒精燈;
⑤燒瓶中不再產生氣泡時,關閉活塞;
⑥待冷卻至室溫,調節兩邊液面高度相平,記錄量氣管中水面讀數為V mL;
⑦處理剩余藥品,整理實驗臺。
【實驗分析及數據處理】:
(1)寫出裝置中儀器的名稱:a、 ;b、 ;
(2)反應的化學方程式為: ;
(3)完善實驗步驟中的所缺部分:① ;
(4)步驟④中,移走酒精燈的目的是 ;
(5)NH4Cl是一種 (填“易溶”、“可溶”、“微溶”、“難溶”)物質。20℃時,其飽和溶液中溶質質量分數為 。根據實驗數據計算,生成氮氣約為多少毫升?(3分,計算過程中,中間數據保留2位小數,最終結果為整數;相對分子質量:Mr-NH4Cl:53.5、Mr-N2:28)
(6)根據計算結果,步驟⑥中V的數值為 ;
(7)實驗中,實際測得氮氣的體積偏大,可能原因是 。
A.實驗中加入飽和NaNO2溶液的體積也被作為生成N2的體積
B.裝置漏氣
查看答案和解析>>
科目:初中化學 來源:2011年第二十一屆“天原杯”全國初中學生化學素質和實驗能力競賽(廣東賽區)初賽試卷(解析版) 題型:填空題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com