將60克鐵粉和銅粉的混合物放入足量的硫酸銅溶液中,完全反應后,共得紅色沉淀68克,求原混合物中銅的質量分數.
【答案】
分析:紅色沉淀為銅,68g銅有兩個來源,一個是混合物中的銅,一個是反應生成的銅,可以設出混合物中銅的質量為x,則生成的銅的質量就是68g-x,鐵粉的質量就是60g-x,通過化學方程式計算出x的質量,然后求出銅的質量分數.
解答:解:設混合物中銅的質量為x,則鐵粉的質量為60g-x,生成的銅的質量為68g-x
Fe+CuSO
4=FeSO
4+Cu
56 64
60g-x 68g-x
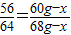
x=4g
故原混合物中銅的質量分數為:
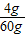
×100%=6.25%
答:原混合物中銅的質量分數為6.25%.
點評:區分開68g銅有兩個來源是正確解決本題的關鍵.

 金博士一點全通系列答案
金博士一點全通系列答案