某草木灰樣品中含兩種鉀鹽 (假設其他未知雜質不溶于水,也不與鹽酸反應),取一定量該草木灰樣品,溶于200g水中,充分溶解后,過濾.向濾液中加入10%的稀鹽酸,至恰好不再產生氣泡為止,消耗稀鹽酸73g,將所得溶液蒸干得到一種成分的固體20g.請回答下面問題:
①寫出反應的化學方程式 ;
②根據題意,列出生成氯化鉀質量(x)的比例式 ;
③將上述加入稀鹽酸后的溶液蒸發掉37.5g水后,所得溶液中溶質的質量分數為 ;
④若要將此反應后溶液稀釋為500g 5%的溶液,則需要加入的溶液中溶質和溶劑的質量比為 .
【答案】
分析:依據草木灰的主要成分是碳酸鉀可知碳酸鉀與鹽酸反應會勝吃呢個氯化鉀和水及二氧化碳,根據消耗鹽酸的量可求生成的氯化鉀的質量,而后利用蒸干后所得固體的質量減去生成的氯化鉀質量即可求得原來除碳酸鉀外的另一種鉀鹽的質量,據此分析解答即可
解答:解:①由于草木灰中含有的主要成分是碳酸鉀,碳酸鉀能與鹽酸反應會生成氯化鉀水及二氧化碳,其方程式為:K
2CO
3+2HCl=2KCl+CO
2↑+H
2O;
②設生成氯化鉀質量為x生成的二氧化碳的質量是y反應的氯酸鉀的質量是z
K
2CO
3+2HCl=2KCl+H
2O+CO
2↑
138 73 149 44
z 73g×10% x y
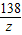
=
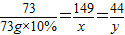
x=14.9g y=4.4g z=13.8g
③由于將所得溶液蒸干得到一種成分的固體20g.所以可知該溶液中的溶質的量是20g,溶液的量是200g+73g+13.8g-4.4g+(20g-14.9g)=287.5g
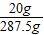
×100%≈7%
④設需要加入的氯化鉀溶液的溶質質量分數為z%,則需加入溶液質量為500g-287.5g=212.5g;
則有20g+212.5g×z%=500g×5%
z%≈2.4%
則需要加入的溶液中溶質和溶劑的質量比為
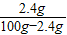
=
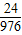
故答案為:①K
2CO
3+2HCl=2KCl+H
2O+CO
2↑;②
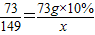
;③7%;④24:976;
點評:本題較難,考查學生利用化學反應方程式的計算,明確在放入鹽酸后發生的化學反應是解答的關鍵.

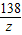 =
=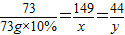
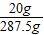 ×100%≈7%
×100%≈7%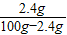 =
=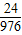
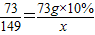 ;③7%;④24:976;
;③7%;④24:976;
