
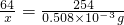
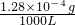 =0.128mg/m3<0.15mg/m3,符合國家標準;
=0.128mg/m3<0.15mg/m3,符合國家標準;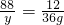
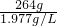 =133.5L
=133.5L 

科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源:不詳 題型:問答題
查看答案和解析>>
科目:初中化學 來源:同步題 題型:填空題
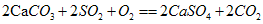 ,實驗證明石灰漿[Ca(OH)2]在空氣中也可吸收SO2生成硫酸鈣和其他物質,寫出該反應的化學方程式:________________________________。
,實驗證明石灰漿[Ca(OH)2]在空氣中也可吸收SO2生成硫酸鈣和其他物質,寫出該反應的化學方程式:________________________________。查看答案和解析>>
科目:初中化學 來源:2003年第十三屆“天原杯”全國初中學生化學素質和實驗能力競賽(遼寧賽區)初賽試卷(解析版) 題型:填空題
查看答案和解析>>
科目:初中化學 來源:《7.3 使用燃料對環境的影響》2010年同步練習(1)(解析版) 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com