
(5分)元素周期表是學習化學的重要工具。下面是元素周期表中1~18號元素原子核外電子排布,我們對它進行研究:

⑴第16號元素屬于_______元素(填“金屬”或“非金屬”),它在化學反應中容易________(填“得”或“失”)電子;
⑵ 元素的化學性質與原子結構中的______________數關系密切;
⑶在同一族中,各元素的原子結構呈現的規律有________________ (任寫一點);
⑷研究表明:第二周期從3~9號元素的原子電子層數相同,核電荷數逐漸增大,核對核外電子的引力逐漸增大,故原子半徑逐漸減小。我分析第三周期從11~17號元素原子半徑變化規律是 _________________________________。
⑴ 非金屬 ;得 ;⑵ 最外層電子 ;⑶ 電子層數遞增或最外層電子數相等或從上到下核電荷數增大等(只要合理均可)⑷ 逐漸減小
【解析】
試題分析:(1)根據原子最外層電子數的特點分析,非金屬元素的原子最外層電子的數目一般多于4個,在化學反應中容易得到電子達到穩定結構;金屬元素的原子最外層電子的數目一般少于4個,在化學反應中容易失去電子達到穩定結構,第16號元素的原子最外層電子數為6,故屬于非金屬元素,在化學反應中容易得到2個電子。
(2)原子核外最外層電子數少于4個,一般容易失去電子形成陽離子;原子核外最外層電子數多于4個的,一般容易得到電子形成陰離子;原子核外最外層電子數為8個(只有一層的有2個電子)的,化學性質一般比較穩定,不容易發生化學變化,故元素的化學性質與原子核外的最外層電子數有密切關系。
(3)根據元素周期表分析,在同一族中(一豎行),從上到下核電荷數依次增大,各元素的原子的電子層數依次遞增,但最外層電子數相等。
(4)根據題意,同一周期中,“核電荷數逐漸增大,核對核外電子的引力逐漸增大,原子半徑逐漸減小”,所以從11~17號元素原子半徑也是逐漸減小。
考點:元素周期表的特點及其應用,原子的定義與構成,核外電子在化學反應中的作用,原子結構示意圖與離子結構示意圖
點評:理解和熟練掌握元素周期表的特點及其應用,是解答本題的關鍵。


科目:初中化學 來源:2013屆山東省濱州市濱城區第三中學九年級上學期期末考試化學試卷(帶解析) 題型:填空題
(5分)元素周期表是學習化學的重要工具。下面是元素周期表中1~18號元素原子核外電子排布,我們對它進行研究: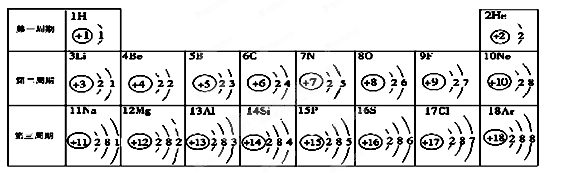
⑴第16號元素屬于_______元素(填“金屬”或“非金屬”),它在化學反應中容易________(填“得”或“失”)電子;
⑵ 元素的化學性質與原子結構中的______________數關系密切;
⑶在同一族中,各元素的原子結構呈現的規律有________________ (任寫一點);
⑷研究表明:第二周期從3~9號元素的原子電子層數相同,核電荷數逐漸增大,核對核外電子的引力逐漸增大,故原子半徑逐漸減小。我分析第三周期從11~17號元素原子半徑變化規律是 _________________________________。
查看答案和解析>>
科目:初中化學 來源:2012-2013學年陜西省西安高新第二學校九年級上學期期中檢測化學試卷(解析版) 題型:填空題
(4分)元素周期表是化學學習和研究的重要工具。下圖是元素周期表的一部分。
|
1 H 1.008 |
|
2 He 4 .003 |
|||||
|
3 Li 6 .941 |
4 Be 9 .012 |
5 B 10.81 |
6 C 12.01 |
7 N 14. 01 |
8 O 16.00 |
9 F 19.00 |
10 Ne 20.18 |
|
11 Na 22.99 |
12 Mg 24.31 |
13 Al 26.98 |
14 Si 28.09 |
15 P 30.97 |
16 S 32.06 |
17 Cl 35.45 |
18 Ar 39.95 |
(1)從表中查出硅(Si)元素的相對原子質量為 ;
(2)6~11號元素中屬于金屬元素的有 (填元素符號);
(3)表中不同種元素最本質的區別是 (填序號);
A.質子數不同 B.中子數不同 C.相對原子質量不同 D.核外電子數不同
(4)科學家宣布已經人工合成了第116號元素,則此元素的核電荷數是 。
查看答案和解析>>
科目:初中化學 來源:2011-2012學年廣東省汕頭市潮南區九年級中考模擬考試化學試卷(解析版) 題型:填空題
(4分) 元素周期表是學習和研究化學的重要工具。下表是元素周期表中的一部分,請按表中信息填空:?
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
|
2 |
3 Li 鋰 6.941 |
4 Be 鈹 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10Ne 氖 20.18 |
|
3 |
11Na 鈉 22.99 |
12Mg ?鎂 24.31 |
13 Al 鋁 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氬 39.95 |
(1)查找出原子序數為10的元素的相對原子質量 。?
(2)硫元素的原子結構示意圖為 ,該元素的原子核外有
個電子層,它屬于
元素(填“金屬”、“非金屬”),其化學性質比較活潑,在化學反應中易 (填“得”、“失”)電子。
,該元素的原子核外有
個電子層,它屬于
元素(填“金屬”、“非金屬”),其化學性質比較活潑,在化學反應中易 (填“得”、“失”)電子。
查看答案和解析>>
科目:初中化學 來源:2010-2011學年廣西百色市畢業暨升學考試化學試卷 題型:填空題
(5分)元素周期表和化學用語都是學習化學的重要工具,回答下列問題:
|
3 Li 鋰 |
4 Be 鈹 |
5 B 硼 |
6 C 碳 |
7 N 氮 |
8 O 氧 |
9 F 氟 |
10 Ne 氖 |
|
11 Na 鈉 |
12 Mg 鎂 |
13 Al 鋁 |
14 Si 硅 |
15 P 磷 |
16 S 硫 |
17 Cl 氯 |
18 Ar 氬 |
(1)同一周期(橫行)中,相鄰兩種元素的質子數之差為 ;磷元素原子核外電子數為 ;
(2)12號元素的單質在空氣中燃燒時,也發生如下反應:2Mg + CO2 點燃 C +2MgO ,該反應中發生還原反應的物質是 ;9號元素的氣體單質(F2)常溫下與水發生反應,生成氫氟酸(HF)各另一種無色氣體,該反應的化學方程式為: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com