
分析 根據反應物、生成物、反應條件及其質量守恒定律可以書寫反應的化學方程式;
根據提供的數據可以進行相關方面的計算;
堿石灰能夠吸收水蒸氣和二氧化碳.
解答 解:(1)氮化鎂與水反應的化學方程式為:Mg3N2+6H2O═3Mg(OH)2+2NH3↑;
(2)設ag鎂和氧氣反應生成的氧化鎂的質量為x,ag鎂和氮氣反應生成氮化鎂的質量為y,
2Mg+O2$\frac{\underline{\;點燃\;}}{\;}$2MgO,3Mg+N2$\frac{\underline{\;點燃\;}}{\;}$Mg3N2,
48 80 72 100
ag x ag y
$\frac{48}{ag}=\frac{80}{x}$,$\frac{72}{ag}=\frac{100}{y}$,
x=$\frac{5a}{3}$g,y=$\frac{25a}{18}$g,
因此ag鎂在空氣中完全燃燒生成固體的總質量m為:$\frac{25a}{18}$<m<$\frac{5a}{3}$;
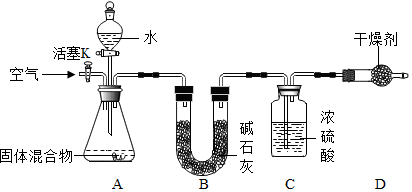
(一)裝置B的作用是吸收水蒸氣;
(二)裝置D的作用是防止空氣中的水蒸氣進入C裝置中;
(三)實驗步驟④中鼓入空氣的目的是使生成的氨氣完全被濃硫酸吸收;
(四)設氮化鎂的質量為z,
裝置C增重0.34g,說明生成了0.34g氨氣,
Mg3N2+6H2O═3Mg(OH)2+2NH3↑,
100 34
z 0.34g
$\frac{100}{z}=\frac{34}{0.34g}$,
z=1g,
固體混合物中Mg3N2的質量分數為:$\frac{1g}{5g}$×100%=20%;
(五)實驗證明此方法測定的結果偏低,可能原因是部分氨氣溶于水中.
故填:Mg3N2+6H2O═3Mg(OH)2+2NH3↑;$\frac{25a}{18}$<m<$\frac{5a}{3}$;吸收水蒸氣;防止空氣中的水蒸氣進入C裝置中;使生成的氨氣完全被濃硫酸吸收;20%;部分氨氣溶于水中.
點評 合理設計實驗,科學地進行實驗、分析實驗,是得出正確實驗結論的前提,因此要學會設計實驗、進行實驗、分析實驗,為學好化學知識奠定基礎.


科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 醫生給病人輸液時,常用葡萄糖注射液或氯化鈉注射液,有時根據病情,也可用葡萄糖復化鈉注射液.如圖所示的是這種注射液的部分標簽.
醫生給病人輸液時,常用葡萄糖注射液或氯化鈉注射液,有時根據病情,也可用葡萄糖復化鈉注射液.如圖所示的是這種注射液的部分標簽.查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com