解:(1)由題可知地殼里含量最高的是金屬鋁,但鋁開發(fā)利用的時間在后,說明金屬大規(guī)模開發(fā)、利用的先后順序與地殼里金屬含量無關,同時與金屬的導電性和延展性也無關,而是與金屬活動性順序和金屬冶煉的難易程度有關;
(2)由題意可知四種金屬的活動性強弱順序為:甲>乙>丙>(H)>丁,因此丙不可能為銅;
(3)反應物為氫氣和氯化亞鐵,生成物是鐵和氯化氫,反應的化學方程式為H
2+FeCl
2
2HCl+Fe,納米鐵在高溫下與空氣中的氧氣發(fā)生反應,因此反應中需要保護氣;
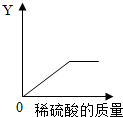
(4)向一定量的鐵粉中逐滴加入稀硫酸至過量,消耗鐵粉的質量、生成硫酸亞鐵的質量、生成氫氣的質量都是先增加,隨著鐵粉的反應完全它們的質量不再增加;溶液的總質量是不斷增加的;
(5)銅、鐵均能與FeCl
3溶液反應,充分反應后燒杯中仍有少量固體,說明FeCl
3不再存在,溶液中一定含FeCl
2;鐵能與氯化銅溶液反應,因此溶液中可能沒有氯化銅,鐵不剩余;
故答案為(1)③;
(2)③;
(3)H
2+FeCl
2
2HCl+Fe;防止生成的納米鐵在高溫下與空氣中的氧氣發(fā)生反應
(4)③
(5)②
分析:金屬的活動性順序的應用主要表現在兩個方面:一是只有排在氫前面的金屬才能與酸發(fā)生置換反應,生成鹽和氫氣;二是只有排在前面的金屬才能把后面的金屬從它的鹽溶液中置換出來;化學方程式的書寫主要做好以下幾個方面:反應物、生成物、反應條件、化學式的書寫、配平、沉淀氣體的標注等.
點評:本題主要是讓我們結合生活常識和所學知識,探究日常生活中常見金屬及其制品的物理和化學性質,涉及知識面比較廣泛.包括:金屬活動順序表、金屬的金屬活動性強弱、金屬性越強的金屬與酸反應速率越快、排在前面的金屬可以將排在后面的金屬從它們的金屬溶液中置換出來、金屬的化學性質等.



 2HCl+Fe,納米鐵在高溫下與空氣中的氧氣發(fā)生反應,因此反應中需要保護氣;
2HCl+Fe,納米鐵在高溫下與空氣中的氧氣發(fā)生反應,因此反應中需要保護氣; 2HCl+Fe;防止生成的納米鐵在高溫下與空氣中的氧氣發(fā)生反應
2HCl+Fe;防止生成的納米鐵在高溫下與空氣中的氧氣發(fā)生反應

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案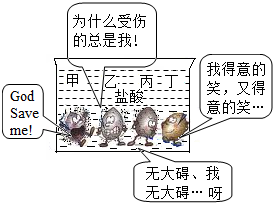

 人類的生活離不開金屬材料
人類的生活離不開金屬材料