
(2012?南昌)下列實驗方案合理的是( )
|


科目:初中化學 來源: 題型:
(2012?南昌)下表物質符合圖中轉化關系的是( )
|
查看答案和解析>>
科目:初中化學 來源: 題型:
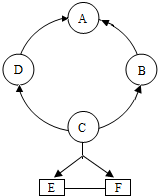 (2012?南昌)如圖所示A~F是初中化學常見的物質.圖中“→”表示轉化關系,“→”表示相互能反應(部分物質和反應條件未標出).其中A是紫紅色金屬,B常溫下是氣體,C是人體胃液中含有的酸.
(2012?南昌)如圖所示A~F是初中化學常見的物質.圖中“→”表示轉化關系,“→”表示相互能反應(部分物質和反應條件未標出).其中A是紫紅色金屬,B常溫下是氣體,C是人體胃液中含有的酸.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com