
 氯化鈣、氯化鈉和碳酸鈉都是生產生活離不開的化工原料.
氯化鈣、氯化鈉和碳酸鈉都是生產生活離不開的化工原料. 解得X=27.75g,根據:
解得X=27.75g,根據: 解得Y=25g,根據:
解得Y=25g,根據: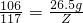 解得Z=29.25g.
解得Z=29.25g. ×100%=10.16%.
×100%=10.16%.

 提分百分百檢測卷系列答案
提分百分百檢測卷系列答案 寶貝計劃期末沖刺奪100分系列答案
寶貝計劃期末沖刺奪100分系列答案 能考試全能100分系列答案
能考試全能100分系列答案科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:

| 溫度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

| 溫度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
 Na2CO3+CO2↑+H2O.
Na2CO3+CO2↑+H2O.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com