
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:初中化學 來源: 題型:閱讀理解
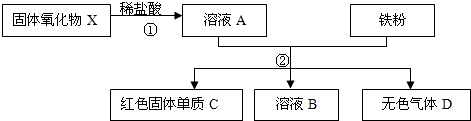
 某企業是一家以生產電纜類產品為主的地方明星企業.在電纜生產過程中,不可避免地會產生一定量的含銅廢料(如:零碎電纜).某化學興趣小組的同學得知這一情況后,提出可以用含銅廢料制備膽礬(CuSO4?5H2O).
某企業是一家以生產電纜類產品為主的地方明星企業.在電纜生產過程中,不可避免地會產生一定量的含銅廢料(如:零碎電纜).某化學興趣小組的同學得知這一情況后,提出可以用含銅廢料制備膽礬(CuSO4?5H2O).

查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解

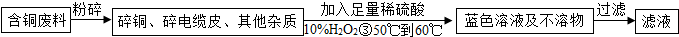
| ||
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
 硫酸銅是生產、生活中常見的物質,下面是某學習小組展開的探究實錄:
硫酸銅是生產、生活中常見的物質,下面是某學習小組展開的探究實錄:
| ||
| ||
| Al片(未打磨) | Al片(打磨) | |
| CuSO4溶液 (5%,5mL) |
無變化,數小時后鋁片上附有極少氣泡,幾乎無紅色物質 | 極少氣泡,附著極少紅色物質,持續較長時間 |
| CuSO4溶液 (10%,5mL) |
無變化,數小時后鋁片附有稍多氣泡,僅有極少紅色斑點 | 稍多氣泡,附著極少(多于5%)紅色物質,持續較長時間 |
| CuCl2溶液 (5%,5mL) |
多量氣泡,迅速出現紅色物質,很快溶液變成無色,且溫度升高 | 更多量氣泡,迅速出現紅色物質,很快溶液變成無色,且溫度升高 |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:初中化學 來源:2011-2012學年江蘇省鎮江市九年級5月中考模擬考試化學試卷(解析版) 題型:探究題
在電纜生產過程中,不可避免地會產生一定量的含銅廢料(如:零碎電纜)。某化學興趣小組提出可以用含銅廢料制備膽礬(CuSO4·XH2O)。
查閱資料:(1)過氧化氫在常溫下會緩慢分解為氧氣和水。對其水溶液加熱、光照或加催化劑(如MnO2 )都會促進其分解。
(2)CuSO4·XH2O可溶于水,在加熱時會生成CuSO4和H2O。
I、硫酸銅的制備
方案1:甲同學根據已學知識,提出了制備硫酸銅方案:

方案2:乙同學根據查閱資料找到了一種工業制備硫酸銅的流程:

(1)寫出上述方案中的②處銅或銅的化合物有關的化學反應方程式是: 。
(2)從環保角度對兩套方案的不同部分進行比較,你認為方案 (填1或2)更合理。理由是: 。
(3)方案2中,加入H2O2后要求溫度控制在50℃到60℃加熱的可能的原因為 。
(4)若上述方案所用的稀硫酸是在實驗室中由稀釋濃硫酸得到,在稀釋濃硫酸時的操作是:
。
(5)興趣小組同學一致指出,將濾液經蒸發、降溫結晶等操作后,用少量95%的酒精淋洗后晾干,得硫酸銅晶體。晶體采用酒精淋洗的優點是 。
II、硫酸銅晶體(CuSO4·xH2O)中結晶水(xH2O)含量的測定
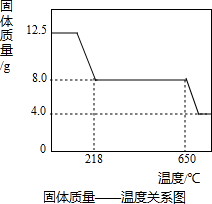
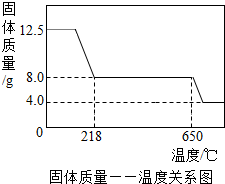
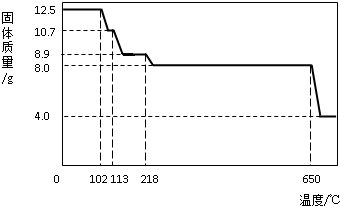
學習小組取12.5g硫酸銅晶體(CuSO4·xH2O)進行熱分解,獲得相關數據,并繪制成固體質量一溫度的關系如圖。

(1)在加熱過程中,隨著水分的失去,固體顏色將由藍色逐漸變為 色,最終變為黑色;
(2)650℃以上時,硫酸銅固體就會發生分解,生成黑色金屬氧化物、二氧化硫及氧氣,此反應的化學方程式為 ;
(3)根據圖中數據,計算CuSO4·xH2O中x的值為 。(請寫出計算過程)
(4)若將4.0g剩余固體繼續加熱到更高的溫度,發現固體質量減少了0.4g后質量不再改變,寫出剩余固體的化學式: 。
Ⅲ、硫酸銅的應用
波爾多液是用硫酸銅和石灰乳配成的一種天藍色、粘稠的懸濁液,其有效成分是Cu4(OH)6SO4,其中銅元素的化合價為 。堿式鹽可以寫成鹽和堿的形式,例如堿式碳酸銅可以寫成CuCO3·Cu(OH)2,則Cu4(OH)6SO4可以寫成鹽和堿的形式為 ,其殺菌機理可看作是Cu2+使病原菌失去活性,這說明病原菌的主體是 (填一種有機物名稱)。
查看答案和解析>>
科目:初中化學 來源:江蘇省模擬題 題型:填空題



查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com