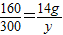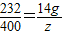用足量CO還原14克鐵的氧化物的混合物,可以得到鐵和CO2.將生成的氣體通入足量澄清的石灰水,可以生成25克沉淀.則該鐵的氧化物的混合物不可能是( )
A.FeO、Fe3O4
B.FeO、Fe2O3
C.Fe2O3、Fe3O4
D.FeO、Fe2O3、Fe3O4
【答案】
分析:解法一:可依據鐵的氧化物與一氧化碳以及二氧化碳和氫氧化鈣反應的方程式推算鐵的氧化物的化學式進而對相關選項作出判斷;
解法二:本題宜采用極端假設的方法解決,可分別假設14g氧化物是某一種具體的鐵的氧化物,并利用物質間的關系式對生成的沉淀量進行計算,從而判斷出鐵的氧化物的具體情況;
解答:解:解法一:假設鐵的氧化物的化學式為Fe
xO
y,則它與一氧化碳反應的方程式為:Fe
xO
y+yCO
xFe+yCO
2,Ca(OH)
2+CO
2═CaCO
3↓+H
2O,所以可建立Fe
xO
y~yCO
2~yCaCO
3的關系式;
則有Fe
xO
y~yCO
2~yCaCO
3
56x+16y 100y
14g 25g


=

則兩元素的質量比為56×5:16×7=5:2,而FeO、Fe
2O
3、Fe
3O
4三者中鐵與氧的質量比分別是:7:2;7:3;21:8;所以可推斷該物質中一定會含有Fe
2O
3;
解法二:根據化學反應結合元素的守恒可以建立鐵的氧化物二氧化碳以及碳酸鈣之間的關系式,并分別進行計算
若全部是FeO,則存在FeO~CO
2~CaCO
3的關系式,設生成的碳酸鈣質量是x
FeO~CO
2~CaCO
372 100
14g x

x=19.44g
若全部是Fe
2O
3,則存在Fe
2O
3~3CO
2~3CaCO
3的關系式,設生成的碳酸鈣質量是y
Fe
2O
3~3CO
2~3CaCO
3
160 300
14g y
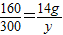
y=26.25g
若全部是Fe
3O
4,則存在Fe
3O
4~4CO
2~4CaCO
3的關系式,設生成的碳酸鈣質量是z
Fe
3O
4~4CO
2~4CaCO
3
232 400
14g z
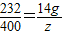
z=24.14g
因為得到CaCO
3沉淀25g,所以必須是混合物,而且必須要有Fe
2O
3.
故選A
點評:本題考查混合物的質量計算,題目難度不大,注意利用極端假設的解題方法并能從質量守恒的角度建立相關的關系式可簡化計算的過程;

 xFe+yCO2,Ca(OH)2+CO2═CaCO3↓+H2O,所以可建立FexOy~yCO2~yCaCO3的關系式;
xFe+yCO2,Ca(OH)2+CO2═CaCO3↓+H2O,所以可建立FexOy~yCO2~yCaCO3的關系式;
 =
=