
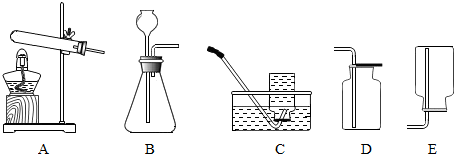
分析 (1)根據實驗室中制取二氧化碳的反應原理和反應條件來選擇反應的發生裝置,根據二氧化碳的密度及水溶性來選擇收集裝置.
(2)根據檢驗二氧化碳使用澄清的石灰水,進行分析解答.
(3)碳酸鈣與稀鹽酸反應生成氯化鈣、水和二氧化碳;根據質量守恒定律,燒杯內質量的減少的質量即生成的二氧化碳質量,據此根據反應的化學方程式列式計算出參加反應碳酸鈣的質量,進而計算出雞蛋殼中所含碳酸鈣的質量分數.
解答 解:(1)實驗室中制取二氧化碳常用大理石或石灰石和稀鹽酸反應來制取,屬于固液常溫型,同時生成氯化鈣、水,反應的化學方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑.應該選擇B裝置來制取二氧化碳氣體;二氧化碳密度比空氣大,能溶于水,所以應該選擇D裝置來收集二氧化碳.
(2)檢驗二氧化碳使用澄清的石灰水,二氧化碳與石灰水反應生成碳酸鈣白色沉淀和水.
(3)①生成二氧化碳氣體的質量是12.5g+40g-48.1g=4.4g.
②設參加反應的碳酸鈣的質量為x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{44}=\frac{x}{4.4g}$ x=10g
雞蛋殼中所含碳酸鈣的質量分數為$\frac{10g}{12.5g}×$100%=80%.
故答案為:(1)BD;CaCO3+2HCl=CaCl2+H2O+CO2↑;(2)澄清的石灰水;碳酸鈣;(3)①4.4;②雞蛋殼中所含碳酸鈣的質量分數為80%.
點評 本題難度不大,是中考的重要考點之一,熟練掌握實驗室中制取氣體的反應原理、發生裝置和收集裝置的選擇依據、化學方程式的有關計算等是正確解答本題的關鍵.


科目:初中化學 來源: 題型:選擇題
| A. | 將植物油與水混合,得到的是溶液 | |
| B. | 物質溶解時,溫度一定升高 | |
| C. | 將一杯食鹽溶液倒出一多半,則倒出的溶液較稀,留在杯中的溶液較濃 | |
| D. | 食鹽溶液不易結冰的原因是食鹽溶液的凝固點比水低 |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
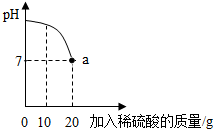 實驗室有一瓶標簽被腐蝕的稀硫酸溶液,小麗為了測定該稀硫酸溶液中溶質的質量分數,在燒杯中配制了16g10%的氫氧化鈉溶液,然后往燒杯中滴加該稀硫酸溶液.反應過程中該溶液的pH與滴入稀硫酸溶液的質量關系如圖所示.請回答下列的問題:
實驗室有一瓶標簽被腐蝕的稀硫酸溶液,小麗為了測定該稀硫酸溶液中溶質的質量分數,在燒杯中配制了16g10%的氫氧化鈉溶液,然后往燒杯中滴加該稀硫酸溶液.反應過程中該溶液的pH與滴入稀硫酸溶液的質量關系如圖所示.請回答下列的問題:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
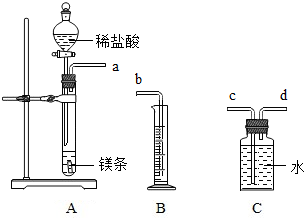 一定質量的鎂與足量鹽酸反應,用排水法測量產生氫氣的體積,查密度表求出氫氣的質量,再根據化學方程式計算出鎂的相對原子質量.請利用如圖給定儀器組裝一套測定鎂的相對原子質量的實驗裝置(每種儀器只用一次),并回答相關問題.
一定質量的鎂與足量鹽酸反應,用排水法測量產生氫氣的體積,查密度表求出氫氣的質量,再根據化學方程式計算出鎂的相對原子質量.請利用如圖給定儀器組裝一套測定鎂的相對原子質量的實驗裝置(每種儀器只用一次),并回答相關問題.查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
 鋅是人體中必需的微量元素,鋅元素的部分信息如圖,則下列說法正確的是( )
鋅是人體中必需的微量元素,鋅元素的部分信息如圖,則下列說法正確的是( )| A. | 鋅的相對原子質量為65.38g | B. | 鋅原子核外電子數為30 | ||
| C. | 鋅原子結構示意圖中X為8 | D. | 鋅原子在反應中容易得到電子 |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
| 金屬 | 導電性(100為標準) | 密度(g/cm3) | 熔點(℃) |
| A | 99 | 8.92 | 1083 |
| B | 61 | 2.70 | 660 |
| C | 17 | 7.86 | 1535 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com