
 小明在檢濺發酵粉(如圖)中小蘇打的含量時.取20g發酵粉放入燒杯中.向其中滴加46g稀鹽酸時恰好不產生氣泡(假設發酵粉中其它成分不反應也不溶于水).測得杯中的混合液61.6g,試回答:
小明在檢濺發酵粉(如圖)中小蘇打的含量時.取20g發酵粉放入燒杯中.向其中滴加46g稀鹽酸時恰好不產生氣泡(假設發酵粉中其它成分不反應也不溶于水).測得杯中的混合液61.6g,試回答: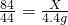 ,
,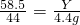
 ×100%=42%
×100%=42%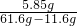 ×100%=11.7%
×100%=11.7%

科目:初中化學 來源: 題型:
 小明在檢濺發酵粉(如圖)中小蘇打的含量時.取20g發酵粉放入燒杯中.向其中滴加46g稀鹽酸時恰好不產生氣泡(假設發酵粉中其它成分不反應也不溶于水).測得杯中的混合液61.6g,試回答:
小明在檢濺發酵粉(如圖)中小蘇打的含量時.取20g發酵粉放入燒杯中.向其中滴加46g稀鹽酸時恰好不產生氣泡(假設發酵粉中其它成分不反應也不溶于水).測得杯中的混合液61.6g,試回答:查看答案和解析>>
科目:初中化學 來源:2009年黑龍江省哈爾濱市道外區中考化學一模試卷(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com