
【題目】工業鐵紅的主要成分是Fe2O3,還含有少量的FeO、Fe3O4,為了測定鐵紅中鐵的質量分數,興趣小組的同學進行了如下實驗,請你參與過程分析。
(資料1)草酸晶體(H2C2O43H2O)在濃H2SO4作用下受熱分解,化學方程式為:
H2C2O43H2O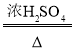 CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
(問題討論)用如圖所示裝置進行實驗:
(1)實驗前應先檢查裝置的氣密性。
(2)進入D中的氣體是純凈、干燥的CO,則A、C中的試劑依次是_____(填字母編號)
a.濃硫酸 b.澄清的石灰水 c.氫氧化鈉溶液
(3)B裝置的作用是_____。
(4)對D裝置加熱前和停止加熱后,都要通入過量的CO,其作用分別是:
①加熱前將裝置中的空氣排出,防止發生爆炸
②停止加熱后_____。
(數據分析與計算)
(資料2)鐵的常見氧化物中鐵的質量分數
鐵的氧化物 | FeO | Fe2O3 | Fe3O4 |
鐵的質量分數 | 77.8% | 70.0% | 72.4% |
(5)稱取鐵紅樣品10.0g用上述裝置進行實驗,測定鐵紅中鐵的質量分數。
①D中充分反應后得到Fe粉的質量為mg,則m的取值范圍是_____。
②實驗前后稱得E裝置增重6.6g,則此鐵紅中鐵的質量分數是_____。(計算結果精確到0.1%)
(實驗評價)
(6)本實驗中如果缺少C裝置(不考慮其它因素),則測得樣品中鐵的質量分數會_____(填“偏小”、“不變”或“偏大”)。
【答案】c、a 檢驗二氧化碳是否被A裝置完全吸收 把反應生成的二氧化碳全部排入E裝置中 7.0<m<7.78 76.0% 偏小
【解析】
(2)進入D中的氣體是純凈、干燥的CO,則需要除去二氧化碳氣體和水蒸氣,氫氧化鈉溶液能和二氧化碳反應生成碳酸鈉和水,除去二氧化碳,濃硫酸能夠吸收水蒸氣;因此裝置A中的試劑為氫氧化鈉溶液,裝置C中的試劑為濃硫酸;故填字母編號為c、a;
(3)二氧化碳能使澄清石灰水變渾濁,用B裝置檢驗二氧化碳是否被A裝置完全吸收;
(4)該實驗的目的是為了測定鐵紅中鐵的質量分數,結合相關裝置、實驗流程及反應原理可知,利用一氧化碳還原鐵的氧化物,生成二氧化碳,通過堿石灰吸收產生的二氧化碳,根據二氧化碳的質量,可以計算鐵紅中氧元素的質量分數,從而計算出鐵元素的質量分數,因此對D裝置加熱前和停止加熱后,都要通入過量的CO,其作用分別是:加熱前將裝置中的空氣排出,防止發生爆炸,停止加熱后把反應生成的二氧化碳全部排入E裝置中;
(5)根據表格中提供的數據可以進行計算:
①D中充分反應后得到Fe粉的質量為mg,鐵存在與三種氧化物中,最大值按FeO中鐵元素的質量分數計算,最小值按Fe2O3中鐵元素質量分數計算,m的取值范圍是:10.0g×70.0%<mg<10.0g×77.8%,即7.0<m<7.78;故填7.0<m<7.78;
②實驗前后稱得E裝置增重6.6g,說明反應生成了6.6g二氧化碳,6.6g二氧化碳中氧元素質量為:6.6g×![]() ×100%=4.8g,二氧化碳中的氧元素一半來自于鐵的氧化物,因此鐵紅中氧元素質量為:4.8g÷2=2.4g,則此鐵紅中鐵的質量分數是:
×100%=4.8g,二氧化碳中的氧元素一半來自于鐵的氧化物,因此鐵紅中氧元素質量為:4.8g÷2=2.4g,則此鐵紅中鐵的質量分數是:![]() ×100%=76.0%,注意計算結果精確到0.1%;故填:76.0%;
×100%=76.0%,注意計算結果精確到0.1%;故填:76.0%;
(6)本實驗中如果缺少C裝置,有水分進入E裝置中,會導致測定的二氧化碳質量偏大,計算時氧元素質量偏大,從而導致測得樣品中鐵的質量分數會偏小;故填偏小。


 名校練考卷期末沖刺卷系列答案
名校練考卷期末沖刺卷系列答案科目:初中化學 來源: 題型:
【題目】某化學興趣小組進行鐵生銹的實驗探究活動。
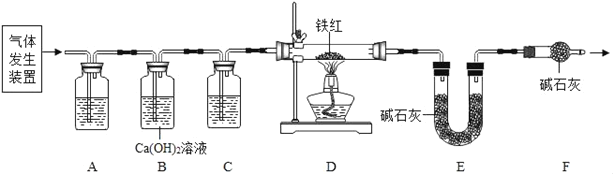
A B C
(探究一)鐵生銹的條件
(1)該興趣小組將潔凈無銹的鐵釘分別置于如圖所示裝置中,經過一段時間觀察_____,(填裝置序號)裝置中出現了明顯的銹跡。
他們的結論:鐵生銹是因為鐵與空氣中的_____等發生了化學反應。
(2)甲同學提出了疑問:空氣中的氮氣、二氧化碳沒有參與鐵的生銹過程嗎?請設計實驗為甲同學釋疑。_____,觀察并記錄現象即可證明。
(探究二)影響鐵生銹速率快慢的因素
乙同學說:媽媽常說菜刀沾有鹽水生銹更快。這種說法對嗎?同學廣泛查閱資料。
資料一:導電性強的溶液都可加速鐵的生銹。
資料二:海上航行的輪船在與海水接觸的部分鑲嵌一鋅塊,能有效降低鋼材被腐蝕的速率。
(3)將上述A裝置中的蒸餾水改為下列液體中的_____,可使鐵生銹的速率加快。
A 硫酸鈉溶液 B 無水乙醇 C 蔗糖溶液
(4)一些建筑的大門刷上了一層銀白色的金屬,你認為該金屬可能是_____。
A 銀粉 B 銅粉 C 鎂粉
(5)寫出一種防止鐵生銹的方法_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】生石灰的主要成分是氧化鈣,與水反應生成氫氧化鈣并放出大量的熱。室溫時,將生石灰加入飽和石灰水中,生石灰對溶解影響的判斷(參照如圖溶解度曲線),錯誤的是( )
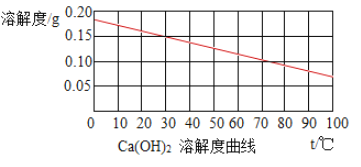
A. 反應中,石灰水始終是飽和溶液
B. 反應中,氧氧化鈣的溶解度增大
C. 反應后,溶液的質量減小
D. 反應后,恢復至室溫時,溶液的質量分數不變
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】在20℃時,某固體物質(不含結晶水)的水溶液,經歷如下變化( )
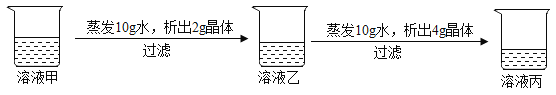
下列說法你認為正確的( )
A. 溶液甲是飽和溶液
B. 20℃時,該固體物質的溶解度是40g
C. 溶液丙若蒸發10g水,析出的晶體一定大于4g
D. 溶液乙溶質的質量分數小于溶液丙溶質的質量分數
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】向一定質量CaCl2和HCl的混合溶液中逐滴加入溶質質量分數為10%的Na2CO3溶液.反應過程中加入的Na2CO3溶液的質量與產生沉淀或氣體的質量關系如圖所示,下列說法正確的是( )
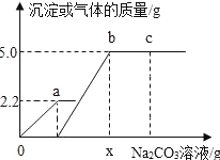
A. 圖中oa段表示生成沉淀的質量
B. b點對應的溶液中溶質為2種
C. c點溶液的PH=7
D. X的值為106
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】廣泛應用于火箭、導彈和飛機制造業的金屬鎂,是利用從海水中提取的鎂鹽制取的,其流程如下圖:
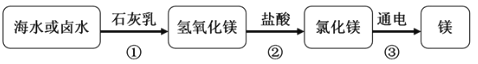
(1)海水提取MgCl2時,經歷了“MgCl2→Mg(OH)2→MgCl2”的轉化過程的目的是_______。
(2)把15. 3gMg(OH)2和MgCl2的混合物加入盛有水的燒杯中,充分溶解后,向燒杯中逐滴加入溶質質量分數為7.3%的稀鹽酸,燒杯中溶液的質量與滴入稀鹽酸的質量關系曲線如下圖所示。試回答下列問題:

①當滴入上述稀鹽酸至圖中A點時,燒杯中溶液里的溶質為__________(寫化學式)。
②當滴入7.3%的稀鹽酸100g時(即圖中B點),恰好完全反應,試通過計算,求此溫度時所得不飽和溶液中溶質的質量________。(計算結果精確至0.1g )
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】現有4瓶失去標簽的溶液,分別為 Ba(NO3)2、H2SO4、BaCl2、NaOH,某同學設計了如圖方案:
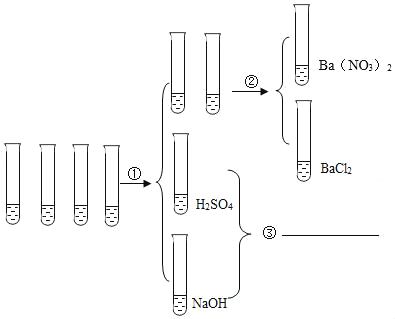
(1)步驟①滴加紫色石蕊溶液,試管中出現_____現象,則該試管盛放的是 NaOH 溶液。
(2)若要區分 Ba(NO3)2 和 BaCl2,則②中需要添加的試劑是_____。
(3)③處兩試管的液體倒入燒杯,請寫出反應的化學方程式_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某廢液中只含有Fe(NO3)2、Cu(NO3)2、Ba(NO3)2三種溶質,為了回收金屬、保護環境,小科設計了如圖方案(所加試劑均過量),下列判斷正確的是( )

A. 溶液B中含有的鹽有Ba(NO3)2、NaNO3
B. 若回收到6.4g固體a,則加入的鐵屑質量為5.6g
C. 固體a是銅
D. X一定是Na2SO4
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】金屬和金屬材料在生產、生活中有廣泛的用途,請用金屬的有關知識填空。
(1)鋰電池可作為無人機的動力,其工作原理是:FePO4+Li![]() LiFePO4.在LiFePO4中鋰元素顯+1價,磷元素顯+5價,則鐵元素的化合價是_____。
LiFePO4.在LiFePO4中鋰元素顯+1價,磷元素顯+5價,則鐵元素的化合價是_____。
(2)鈦(Ti)具有硬度大,密度小,熔點高,抗腐蝕性能好等優良性能,被譽為“未來金屬”。已知Ti2(SO4)3溶于水溶液呈紫色。Ti2O3(紫黑色固體)在加熱條件下可溶于硫酸,生成Ti2(SO4)3.可觀察的現象是_____,反應的化學方程式為_____。
(3)工業上,用一氧化碳和赤鐵礦煉鐵的化學方程式為_____,計算用1000t含氧化鐵80%的赤鐵礦石,理論上能冶煉出鐵的質量為_____t。
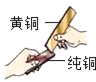
(4)黃銅片(銅鋅合金)與銅片互相刻劃時,(如圖所示),純銅片上留下明顯的劃痕,說明_____;
將它們分別放入稀硫酸中能產生氣泡的是_____;涉及的化學反應可用化學方程式表示為_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com