
分析 由質量守恒定律,固體物質減少的質量均為生成二氧化碳的質量,由反應的化學方程式計算出石灰石中碳酸鈣的質量,進而計算出石灰石樣品中CaCO3的質量分數.
解答 解:由質量守恒定律,生成二氧化碳的質量為14g-9.6g=4.4g.
CaCO3$\frac{\underline{\;高溫\;}}{\;}$CaO+CO2↑
100 44
x 4.4g
$\frac{100}{44}=\frac{x}{4.4g}$ x=10g
石灰石樣品中CaCO3的質量分數為$\frac{10g}{14g}$×100%≈71.4%.
答:石灰石樣品中CaCO3的質量分數為71.4%.
點評 本題難度不大,掌握根據化學方程式的計算即可正確解答本題,根據質量守恒定律計算出二氧化碳的質量是正確解答本題的前提和關鍵.


 同步練習強化拓展系列答案
同步練習強化拓展系列答案科目:初中化學 來源: 題型:選擇題
| A. | 肯定大于15毫升 | B. | 肯定少于15毫升 | C. | 肯定等于15毫升 | D. | 無法確定 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 加入稀硫酸的質量/g | 10 | 10 | 10 | 10 |
| 剩余固體的質量/g | 8.7 | 7.4 | 7 | 7 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
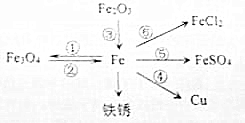 如圖所示,寫出有關化學方程式(注:②③要求各寫三個)
如圖所示,寫出有關化學方程式(注:②③要求各寫三個)查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com