
用過氧化氫制氧氣時,有同學對事先在燒瓶中加水產(chǎn)生了疑問.他提出了猜想:
猜想1:加水可以起到稀釋的作用,使反應速度變緩.
猜想2:…
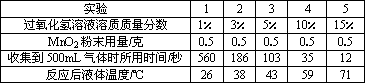
并根據(jù)猜想進行了實驗:每次取15毫升15%的過氧化氫溶液,稀釋成不同溶質質量分數(shù),在其他條件相同的情況下進行實驗.記錄數(shù)據(jù)如下:
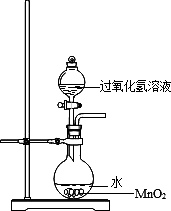
(1)實驗室用過氧化氫制氧氣的化學方程式是________.
(2)過氧化氫溶液的溶質質量分數(shù)對反應速度有怎樣的影響?________.
(3)根據(jù)表中數(shù)據(jù)可知,該同學的猜想2是:加水可以________.
|
答案:(1)2H2O2 (2)一定范圍內(nèi),過氧化氫溶質質量分數(shù)越大反應速度越快; (3)給溶液降溫; 分析:(1)依據(jù)雙氧水分解制氧氣的產(chǎn)物及條件書寫方程式即可; (2)分析表中的數(shù)據(jù)要研究一種條件對化學反應的影響,就要保持其它條件不變,只改變要研究的條件,觀察對其對實驗結果的影響,由表中收集到500 ml氣體所用時間的長短可得到解答. (3)依據(jù)過氧化氫溶質質量分數(shù)越低反應后溶液的溫度也越低,可猜想加入水時可能對反應后溶液有降溫作用; 解答:解:(1)雙氧水在二氧化錳做催化劑的情況下可分解生成水和氧氣,其方程式為:2H2O2 (2)由表中數(shù)據(jù)可知,其它條件不變的情況下,雙氧水溶質質量分數(shù)越高生成500 mL氧氣所用的時間越短,即反應速度越快,但反應所用的時間與溶質質量分數(shù)不成比例,所以此規(guī)律因該是在一定范圍內(nèi)成立; (3)由表中數(shù)據(jù)可知,溶質質量分數(shù)越小的過氧化氫溶液反應后溶液的溫度越低,即加水越多反應后溶液的溫度越低,所以可猜測加水可以對溶液降溫; 點評:此題是對雙氧水制氧氣的探究,分析時采用控制變量的方法對問題進行分析是解決此類題常用的方式; |
|
實驗探究物質變化的條件和影響物質變化的因素. |


 超能學典單元期中期末專題沖刺100分系列答案
超能學典單元期中期末專題沖刺100分系列答案 黃岡360度定制密卷系列答案
黃岡360度定制密卷系列答案 陽光考場單元測試卷系列答案
陽光考場單元測試卷系列答案 名校聯(lián)盟沖刺卷系列答案
名校聯(lián)盟沖刺卷系列答案科目:初中化學 來源: 題型:
 (2012?湖州)用過氧化氫制氧氣時,有同學對事先在燒瓶中加水產(chǎn)生了疑問.他提出了猜想:
(2012?湖州)用過氧化氫制氧氣時,有同學對事先在燒瓶中加水產(chǎn)生了疑問.他提出了猜想:| 實驗 | 1 | 2 | 3 | 4 | 5 |
| 過氧化氫溶液溶質質量分數(shù) | 1% | 3% | 5% | 10% | 15% |
| MnO2粉末用量/克 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
| 收集到500mL氣體時所用時間/秒 | 560 | 186 | 103 | 35 | 12 |
| 反應后液體溫度/℃ | 26 | 38 | 43 | 59 | 71 |
| ||
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
| ||
| ||
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com