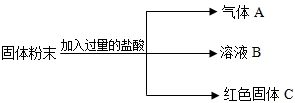
有一包固體粉末,可能含有硫酸鉀、碳酸鈣、硝酸鈣、氯化鋇中的一種或幾種.取少量該固體粉末加到足量的水中,充分振蕩,得到白色沉淀,向該白色沉淀中加入稀硝酸,只有部分溶解,且有氣體放出.請你回答:
(1)該固體粉末中一定含有 .
(2)寫出實驗過程中發生的反應的化學方程式:
① ;
② .
【答案】分析:在推斷所給的混合物的組成時,可以首先將混合物放入水中,根據出現的現象來判斷有哪些物質,然后再根據往所得的沉淀中加其它試劑,來確定沒有哪些物質.
解答:解:因取少量該固體粉末加到足量的水中,有白色沉淀,所以我們可以確定混合物中可能存在碳酸鈣.因碳酸鈣不溶于水.白色沉淀也可能是反應生成的.在沉淀中滴加稀硝酸,沉淀部分溶解,說明沉淀中一定含有碳酸鈣,同時在沉淀中還含有硫酸鋇.要出現硫酸鋇,一定在混合物中含有硫酸鉀和氯化鋇.這兩種物質在溶液中反應生成硫酸鋇.而混合物中的硝酸鈣,我們不能確定有還是沒有.
故答案為:
(1)硫酸鉀、碳酸鈣、氯化鋇
(2)①K2SO4+BaCl2=BaSO4↓+2KCl
②CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O
點評:在初中階段我們所學過的物質中,只有硫酸鋇和氯化銀即不溶于水,也不溶于酸.所以我們在做題時,若出現不溶于水也不溶于酸的沉淀,那么我們一定會判斷是這兩種物質.