
31.(4分)現有銅與金屬鎂、鐵、鋅中的一種組成的混合物,現欲測定其組成。
【查閱資料】鎂、鐵、鋅皆能與稀硫酸發生置換反應,且生成+2價的可溶性金屬化合物和氫氣。
【實驗步驟及數據】取該混合物粉末8.0 g放入燒杯中,將140.0 g 溶質的質量分數為14.0%的稀硫酸平均分四次加入該燒杯中,充分反應后,測得剩余固體質量數據記錄如圖:
通過計算(寫出計算過程),求:
(1)該混合物粉末中銅的質量分數?
(2)第三次加入硫酸充分反應后,所得溶液中溶質的質量分數是多少?
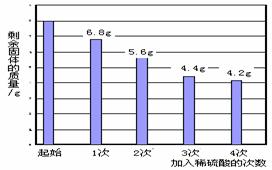
(4分)
解:⑴混合物中Cu的質量分數=![]() …………………………1分
…………………………1分
⑵設M金屬單質的相對原子質量為X,所得溶液中MgSO4的質量為y,生成H2的質量為z
M + H2SO4=== MSO4 + H2↑…………………………………………1分
X 98 2
8g-4.4g 105g×14% y z
X:98=3.6g:35g×14% X=24…………………………………………1分
該金屬是鎂。
98:120==105g×14%:y y=18g
98:2====105g×14%:z z=0.3g
MgSO4溶液的質量分數為18g/(105g+3.6g-0.3g) ×100%≈16.6%.........1分
答:該混合物粉末中銅的質量分數是52.5%;第三次加入硫酸充分反應后,所得溶液中溶質的質量分數是16.6%.


科目:初中化學 來源: 題型:
| 次數 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的質量/g | 35.O | 35.0 | 35.O | 35.O |
| 剩余固體的質量/g | 6.8 | 5.6 | 4.4 | 4.2 |
查看答案和解析>>
科目:初中化學 來源: 題型:
| 次數 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的質量/g | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固體的質量/g | 12.75 | 9.5 | 6.25 | 5.6 |
查看答案和解析>>
科目:初中化學 來源: 題型:
| 次數 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的質量/g | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固體的質量/g | 6.8 | 5.6 | 4.4 | 4.2 |
查看答案和解析>>
科目:初中化學 來源: 題型:
| 次數 | 1 | 2 | 3 | 4 |
| 加入稀鹽酸的質量/g | 40.0 | 40.0 | 40.0 | 40.0 |
| 燒杯中剩余物質的質量/g | 59.88 | 99.76 | 139.64 | 179.60 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com