(2006?菏澤)學校化學興趣小組為測定我市一鑄造廠原料生鐵中鐵的質量分數,在實驗室將8.7g生鐵樣品放入燒杯中,加入50g稀硫酸恰好完全反應(雜質不參加反應),反應后稱得燒杯中剩余物質的總質量為58.4g,求:
(1)產生氫氣的質量是多少?
(2)該生鐵樣品中鐵的質量分數?(結果保留一位小數)
【答案】
分析:生鐵為含碳2%~4.3%的鐵合金,其中鐵與硫酸反應生成硫酸亞鐵和氫氣;根據質量守恒定律,反應前后燒杯中物質總質量差即為放出氫氣的質量,根據氫氣的質量利用反應的化學方程式可計算出恰好完全反應時消耗鐵的質量,即樣品中鐵的質量,據此可計算樣品中鐵的質量分數.
解答:解:(1)恰好完全反應后產生氫氣的質量=8.7g+50g-58.4g=0.3g
(2)設恰好完全反應消耗鐵的質量為x
Fe+H
2SO
4=FeSO
4+H
2↑
56 2
x 0.3g

x=8.4g
生鐵樣品中鐵的質量分數=
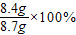
≈96.6%
答:(1)產生氫氣的質量是0.3g;
(2)該生鐵樣品中鐵的質量分數約為96.6%.
點評:在任何與周圍隔絕的體系中,不論發生何種變化或過程,其總質量始終保持不變.反應中因氫氣放出而使燒杯內物質總質量變小,這是解決本題的關鍵.


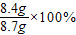 ≈96.6%
≈96.6%

 應用題天天練四川大學出版社系列答案
應用題天天練四川大學出版社系列答案