30克不純的鐵與足量的稀鹽酸反應,產生了1克氫氣,則該鐵樣品中含的雜質可能是( )
A.Cu
B.Mg
C.Al
D.Na
【答案】
分析:根據鐵與鹽酸反應的化學方程式可以計算出產生1g氫氣所需純鐵的質量,確定不純的鐵中所含的雜質具備的條件,根據金屬完全反應產生氫氣的質量=
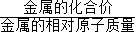
×金屬的質量,判斷可能含有的金屬.
解答:解:設產生了1g氫氣消耗的純鐵的質量為x.
Fe+2HCl=FeCl
2+H
2↑
56 2
x 1g
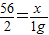
x=28g
28g<30g,說明不純的鐵中所含的雜質可能是不能與鹽酸反應或等質量的鐵和所含雜質相比,雜質與鹽酸反應產生的氫氣少.
金屬完全反應產生氫氣的質量=

×金屬的質量,故等質量的鐵、鎂、鋁、鈉產生氫氣的質量質量由多到少的順序是:鋁>鎂>鈉>鐵.
A、銅不與稀鹽酸反應,故符合要求.
B、等質量的鐵、鎂產生氫氣的質量為鐵<鎂,不符合要求.
C、等質量的鐵、鎂產生氫氣的質量為鐵<鋁,不符合要求.
D、等質量的鐵、鎂產生氫氣的質量為鐵<鈉,不符合要求.
故選A.
點評:本題有一定難度,考查了學生應用化學方程式計算判斷金屬的成分,本題解題關鍵是所含雜質:不能與鹽酸反應或能產生氫氣且與鐵的質量相等時比鐵產生的氫氣少.

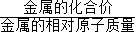 ×金屬的質量,判斷可能含有的金屬.
×金屬的質量,判斷可能含有的金屬.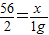 x=28g
x=28g ×金屬的質量,故等質量的鐵、鎂、鋁、鈉產生氫氣的質量質量由多到少的順序是:鋁>鎂>鈉>鐵.
×金屬的質量,故等質量的鐵、鎂、鋁、鈉產生氫氣的質量質量由多到少的順序是:鋁>鎂>鈉>鐵.
