


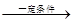 4CO2+2H2O
4CO2+2H2O 4CO2+2H2O;
4CO2+2H2O;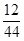 ×100%=12g、H元素質量=9g×
×100%=12g、H元素質量=9g×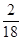 ×100%=1g,其中C、H元素質量和=12g+1g=13g正好等于參加反應的A物質的質量,說明物質A中只含C、H兩種元素,且C、H兩元素的質量比=12g:1g=12:1;則碳氫原子個數比是1:1,因是焊接常用氣體,則該氣體是C2H2。
×100%=1g,其中C、H元素質量和=12g+1g=13g正好等于參加反應的A物質的質量,說明物質A中只含C、H兩種元素,且C、H兩元素的質量比=12g:1g=12:1;則碳氫原子個數比是1:1,因是焊接常用氣體,則該氣體是C2H2。

科目:初中化學 來源:不詳 題型:填空題

 , 從原子結構分析,下列元素化學性質與氟相似的是 (填序號)。
, 從原子結構分析,下列元素化學性質與氟相似的是 (填序號)。

查看答案和解析>>
科目:初中化學 來源:不詳 題型:填空題
 ,則a的值為 。
,則a的值為 。查看答案和解析>>
科目:初中化學 來源:不詳 題型:問答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com