14.黃鐵礦(主要成分為FeS
2,雜質不含硫元素)是我國大多數硫酸廠制取硫酸的主要原料.化學課外活動小組為測定某黃鐵礦中FeS
2含量進行了如下的實驗探究(假設每步反應均完全).
【查閱資料】①4FeS
2+11O
2$\frac{\underline{\;高溫\;}}{\;}$2Fe
2O
3+8SO
2②Na
2SO
3+H
2O
2=Na
2SO
4+H
2O
【實驗探究】Ⅰ.稱取1.60g黃鐵礦樣品放入下圖所示裝置(夾持和加熱裝置省略)的石英管中,從a處不斷地緩緩通入空氣,高溫灼燒石英管中的黃鐵礦樣品至反應完全.
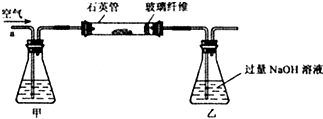
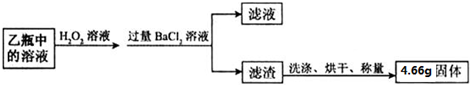
Ⅱ.反應結束后,將乙瓶中的溶液進行如下處理:
【問題討論】(1)Ⅰ中裝置中甲瓶內盛放的試劑是氫氧化鈉溶液,其作用是吸收空氣中的二氧化碳.
【含量測定】(2)Ⅱ中最終得到的4.66g固體是BaSO
4(填物質的名稱或化學式).
(3)計算該黃鐵礦中FeS
2的質量分數.(請寫出計算過程)
【交流反思】(4)如果缺少甲裝置,則最終測得FeS
2的質量分數將會偏大(填“偏大”“偏小”或“不變”).
(5)Ⅱ中證明所加BaCl
2溶液過量的方法是取濾液少許于試管中,滴加氯化鋇溶液,若沒有白色沉淀,則氯化鋇過量.
【拓展應用】工業上以黃鐵礦為原料生產硫酸的工藝流程圖如下圖所示:
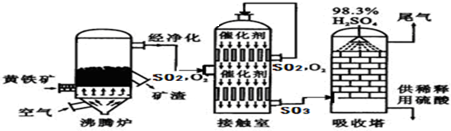
(6)接觸室中發生反應的化學方程式為2SO
2+O
2$\frac{\underline{催化劑}}{△}$2SO
3.化學實驗室現有質量分數為98%的濃硫酸,但在實驗中常需要用到較稀的硫酸.要把100g上述濃硫酸稀釋成質量分數為10%的硫酸,需要水的質量是880gg.硫酸是一種重要的化工產品,用途十分廣泛,請寫出稀硫酸的一種用途除鐵銹.
(7)依據生產硫酸的工藝流程圖,下列說法正確的是ACD(填字母).
A.為使黃鐵礦充分燃燒,需將其粉碎B.催化劑能夠提高SO
2的反應速率和產量
C.SO
2可做為生產硫酸的原料循環再利用D.沸騰爐排出的礦渣可供煉鐵.

 超能學典應用題題卡系列答案
超能學典應用題題卡系列答案