
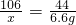
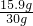 ×100%=53.0%
×100%=53.0%

 一本好題口算題卡系列答案
一本好題口算題卡系列答案科目:初中化學 來源: 題型:
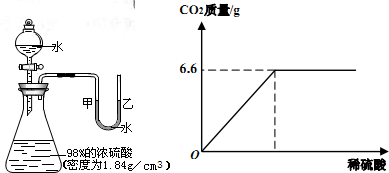
 14、如圖所示的裝置,打開分液漏斗的活塞,讓水滴入錐形瓶中可以看到水浮在硫酸上面且水立即沸騰,硫酸液滴飛濺,同時U形管中甲端下降,乙端上升.這個實驗說明了
14、如圖所示的裝置,打開分液漏斗的活塞,讓水滴入錐形瓶中可以看到水浮在硫酸上面且水立即沸騰,硫酸液滴飛濺,同時U形管中甲端下降,乙端上升.這個實驗說明了查看答案和解析>>
科目:初中化學 來源: 題型:

查看答案和解析>>
科目:初中化學 來源:2012年內蒙古巴彥淖爾市磴口縣誠仁中學中考化學一模試卷(解析版) 題型:填空題
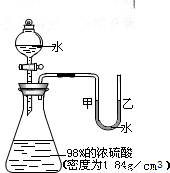 如圖所示的裝置,打開分液漏斗的活塞,讓水滴入錐形瓶中可以看到水浮在硫酸上面且水立即沸騰,硫酸液滴飛濺,同時U形管中甲端下降,乙端上升.
如圖所示的裝置,打開分液漏斗的活塞,讓水滴入錐形瓶中可以看到水浮在硫酸上面且水立即沸騰,硫酸液滴飛濺,同時U形管中甲端下降,乙端上升.查看答案和解析>>
科目:初中化學 來源:2011年河北省中考化學仿真模擬試卷(一)(解析版) 題型:填空題
 如圖所示的裝置,打開分液漏斗的活塞,讓水滴入錐形瓶中可以看到水浮在硫酸上面且水立即沸騰,硫酸液滴飛濺,同時U形管中甲端下降,乙端上升.
如圖所示的裝置,打開分液漏斗的活塞,讓水滴入錐形瓶中可以看到水浮在硫酸上面且水立即沸騰,硫酸液滴飛濺,同時U形管中甲端下降,乙端上升.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com