
 備戰中考寒假系列答案
備戰中考寒假系列答案科目:初中化學 來源: 題型:閱讀理解

| ||
| ||
| 工業純堿標準:(Na2CO3%》) | ||
| 優等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
| ||
| 物質 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| 實驗一 | 實驗二 | 實驗三 | 實驗四 | |
| 固體混合物溶液質量 | 100g | 100g | 100g | 100g |
| 加入CaCl2溶液質量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的質量 | 4g | m | 10g | 10g |
| 工業純堿標準:(Na2CO3% ) | |||
| 優等品 | 一等品 | 合格品 | 次品 |
| ≥95 | ≥80 | ≥75 | ≤40 |
查看答案和解析>>
科目:初中化學 來源: 題型:
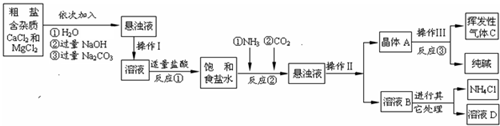
某制堿廠以海水為主要原料生產純堿(碳酸鈉)和其他副產品。
(一)將海水進行處理后獲得精鹽水。海水中,除氯化鈉外,還含有氯化鎂、氯化鈣、硫酸鈉
等雜質。其處理的主要流程如下:

(1)加入氫氧化鈉溶液的目的是 。
(2)操作Ⅰ所得的沉淀是混合物,其成分有(至少寫兩種): 。
(3)向濾液中滴加稀鹽酸目的是 。
(二)將精鹽水制成飽和溶液,先向其中通入足量的氨氣,再向其中通入足量的二氧化碳至有大量晶體(碳酸氫鈉,NaHCO3)析出;將晶體轉移出來后,加熱至不再有氣體產生,所得固體即為純堿。
(4)制堿過程中獲得的副產品可做化肥,其化學式為 。
組成確定
(5)①稱取一定質量的純堿樣品,經多次充分加熱后,再稱重,質量無變化;② 另取少量純堿樣品加入適量水,樣品完全溶解,向該溶液中加入過量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述實驗可確定純堿樣品含有雜質 (寫化學式)。
含量測定
(6)稱取純堿樣品21.5g,加入到盛有足量稀鹽酸的燒杯中,并不斷用玻璃棒攪拌。反應過程用精密儀器測得燒杯內混合物的質量(m)與反應時間(t)關系如圖所示。
請通過計算并結合右表判斷此純堿樣品等級為 ![]() 品。
品。
計算過程:
總結反思
(7)某同學認為,在上述純堿含量測定過程中,用玻璃棒不斷攪拌,能使測定誤差會減小,
其理由是 。
 |
查看答案和解析>>
科目:初中化學 來源: 題型:
信息時代產生的大量電子垃圾對環境構成了極大的威脅。某“變廢為寶”學生探究小組將一批廢棄的線路板簡單處理后,將得到的紅色金屬M和金屬E進行如下框圖所示轉化,獲得高效凈水劑K2EO4.(答題時,化學式及化學方程式中的M、E均用所對應的元素符號表示):

(1)寫出M溶于稀H2SO4和H2O2混合液的離子方程式 。
(2)檢驗X中陽離子的方法和現象是 。
(3)某同學取X的溶液在空氣中放置后,酸化并加入KI和淀粉溶液,溶液變為藍色。試用離子方程式表示溶液變為藍色的原因: 。
(4)由MSO4的藍色溶液經一系列操作可以獲得藍色晶體,這些操作中用到的實驗儀器除了酒精燈、燒杯、玻璃棒、漏斗、鐵架臺外,還需要用到的硅酸鹽儀器有 (填寫儀器名稱)。
(5)某同學利用H2還原MO來測定M的相對原子質量,下圖是測定裝置示意圖。A中試劑是鹽酸。

①裝置D的作用 ;
②連接好裝置并檢驗裝置的氣密性后,應首先“加熱反應管E”還是“從A瓶中逐滴加入液體”? 在這兩步之間還應進行的操作是 。
③該實驗設計是否還有不足之處?若有請指出并改進,如沒有本問可不答。
(6)試說明K2EO4可用作高效凈水劑的原因 。
查看答案和解析>>
科目:初中化學 來源:2011-2012學年江蘇省鹽城市建湖實驗中學九年級(下)期中化學試卷(解析版) 題型:解答題

 NH3↑+HCl↑
NH3↑+HCl↑| 物質 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| 實驗一 | 實驗二 | 實驗三 | 實驗四 | |
| 固體混合物溶液質量 | 100g | 100g | 100g | 100g |
| 加入CaCl2溶液質量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的質量 | 4g | m | 10g | 10g |
| 工業純堿標準:(Na2CO3% ) | |||
| 優等品 | 一等品 | 合格品 | 次品 |
| ≥95 | ≥80 | ≥75 | ≤40 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com