
| 實驗序號 | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入稀硫酸的質(zhì)量(克) | 20 | 20 | 20 | 20 |
| 充分反應后剩余固體的質(zhì)量(克) | 17.2 | 14.4 | 12.0 | m |
分析 (1)分析反應及實驗數(shù)據(jù):根據(jù)金屬活動性,合金中只有鐵可以與硫酸反應;根據(jù)質(zhì)量守恒定律,由第1次實驗數(shù)據(jù)可知,每加入20g稀硫酸完全反應可消耗鐵20g-17.2g=2.8g,據(jù)此分析,第3次加入20g稀硫酸時消耗鐵質(zhì)量14.4g-12.0g=2.4g<2.8g,可判斷此時合金中金屬鐵已完全反應,所以,第4次加入的稀硫酸不再消耗鐵;
(2)使用金屬鐵完全反應時剩余固體銅的質(zhì)量,計算樣品中金屬鐵的質(zhì)量,利用鐵的質(zhì)量與樣品的質(zhì)量比計算黃銅樣品中鐵的質(zhì)量分數(shù);
(3)使用第1次實驗數(shù)據(jù),由生成氫氣的質(zhì)量,根據(jù)反應的化學方程式,計算參加反應硫酸的質(zhì)量,利用硫酸的質(zhì)量與所加稀硫酸的質(zhì)量比計算所用稀硫酸中硫酸的質(zhì)量分數(shù).
解答 解:(1)根據(jù)質(zhì)量守恒定律,由第1次實驗數(shù)據(jù)可知,每加入20g稀硫酸完全反應消耗鐵20g-17.4g=2.6g,據(jù)此分析,第4次加入20g稀硫酸時小寒心質(zhì)量12.2g-12.0g=0.2g<2.6g,可判斷此時合金中金屬鐵已完全反應,所以,第5次加入的稀硫酸不再消耗金屬而不再放出氫氣,因此充分反應后剩余固體的質(zhì)量仍為12g;
故答案為:12.0(或12);
(2)黃銅樣品中鐵的質(zhì)量分數(shù)=$\frac{20g-12g}{20g}$×100%=40%;
故答案為:40%;
(3)設所用稀硫酸中硫酸的質(zhì)量分數(shù)為x,據(jù)題意得:
H2SO4 +Fe═FeSO4+H2↑(1分)
98 56
20g×x 20g-17.2g=2.8g
$\frac{98}{20g×x}$=$\frac{56}{2.8g}$
x=24.5%
答:所用稀硫酸中溶質(zhì)的質(zhì)量分數(shù)為24.5%.
點評 計算所用稀硫酸的溶質(zhì)質(zhì)量分數(shù)時,注意選取稀硫酸完全反應時的實驗數(shù)據(jù)即前三次實驗的數(shù)據(jù)進行計算.


 名師點撥卷系列答案
名師點撥卷系列答案 英才計劃期末調(diào)研系列答案
英才計劃期末調(diào)研系列答案科目:初中化學 來源: 題型:選擇題
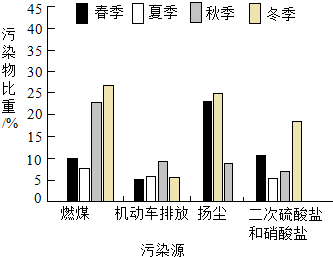 如圖為北京市PM2.5污染物來源的季節(jié)變化特征,其中季節(jié)變化特征最不明顯的污染源來自( )
如圖為北京市PM2.5污染物來源的季節(jié)變化特征,其中季節(jié)變化特征最不明顯的污染源來自( )| A. | 燃煤 | B. | 機動車排放 | ||
| C. | 揚塵 | D. | 二次硫酸鹽和硝酸鹽 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | Cu | B. | Fe | C. | Cu和Zn | D. | Cu和Fe |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| 選項 | 物質(zhì)(括號內(nèi)為雜質(zhì)) | 除雜試劑 | 分離方法 |
| A | 氯化鈉固體(碳酸鈉) | 稀鹽酸 | 蒸發(fā)結(jié)晶 |
| B | 氫氧化鈉溶液(氫氧化鈣溶液) | 二氧化碳氣體 | 過濾 |
| C | 氯化銅溶液(氯化鋅) | 金屬銅 | 過濾 |
| D | 氯化鈉(氯化鎂) | 過量氫氧化鈉溶液 | 過濾、蒸發(fā)結(jié)晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
| 質(zhì)量/g | |
| 坩堝 | W |
| 坩堝+FeSO4•xH2O | W1 |
| 坩堝+FeSO4 | W2 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com