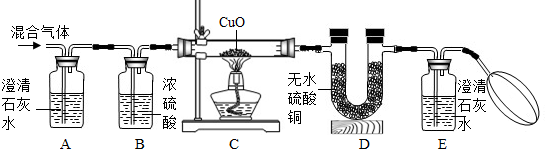
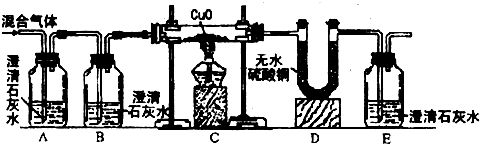
解:(1)在化學反應前后,元素的種類是不發生改變的,反應前的物質中沒有氮元素,生成物中也不會有氮元素,所以水和碳反應后不會生成氮氣,
故答案為:質量守恒定律,
(2)①二氧化碳能使澄清石灰水變渾濁,根據石灰水變渾濁的現象,可以確定混合其中存在二氧化碳,故答案為:CO
2,
②水能夠使無水硫酸銅變藍,氫氣和氧化銅反應會生成水,只要D中的無水硫酸銅變藍,就證明水的存在,也證明了混合氣中有氫氣,
故答案為:D中硫酸銅變成藍色物質,
③二氧化碳能使澄清石灰水變渾濁,一氧化碳和氧化銅反應會生成二氧化碳,只要澄清石灰水變渾濁,證明了二氧化碳的存在,也證明了混合氣中有一氧化碳,
故答案為:E中澄清石灰水變渾濁,
(3)①根據焦炭和水在高溫條件下生成氫氣和一氧化碳,書寫化學方程式,故答案為:C+H
2O

CO+H
2,
②氫氧化鈣的溶解度較小除去二氧化碳不徹底,會對后面的一氧化碳的檢驗產生影響,氫氧化鈉吸收二氧化碳比較完全,故答案為:NaOH.
分析:(1)根據質量守恒定律的微觀解釋分析解答,化學反應前后元素的種類不變,
(2)①檢驗二氧化碳常用澄清石灰水,
②根據氫氣還原氧化銅生成的水會使無水硫酸銅變藍的性質檢驗,
③根據一氧化碳還原氧化銅生成的二氧化碳會使澄清石灰水變渾濁的性質檢驗,
(3)①結合反應物、生成物和反應條件書寫方程式,
②氫氧化鈣的溶解度較小除去二氧化碳不徹底,會對一氧化碳的檢驗產生影響.
點評:本題主要考查了常見氣體的檢驗和除雜方法,以及質量守恒定律在在化學方程式中的應用.


 CO+H2,
CO+H2,

 能考試期末沖刺卷系列答案
能考試期末沖刺卷系列答案