實驗室用6.5g鋅與100g稀硫酸反應制取氫氣,兩者恰好完全反應,求:
(1)制得氫氣的質量;
(2)反應后所得溶液中ZnSO4的質量分數(精確到0.1%).(已知:Zn+H2SO4═ZnSO4+H2↑)
解:設生成硫酸鋅的質量為x,生成氫氣的質量為y
Zn+H
2SO
4=ZnSO
4+H
2↑
65 161 2
6.5g x y
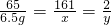
x=16.1g y=0.2g
硫酸鋅溶液的溶質質量分數=
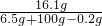
×100%=15.1%
答:(1)生成氫氣的質量為0.2g;
(2)反應后所得溶液中溶質的質量分數為15.1%.
分析:根據鋅與硫酸反應的化學方程式,由6.5g鋅的質量計算恰好完全反應時放出氫氣的質量及反應生成硫酸鋅的質量,然后分別利用溶液中溶質質量分數的計算公式,求出反應后所得溶液中溶質的質量分數.
點評:根據質量守恒定律,反應后所得溶液的質量=參加反應金屬的質量+加入的稀硫酸的質量-放出氣體的質量是解題的關鍵.

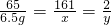
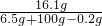 ×100%=15.1%
×100%=15.1%
