
為測定石灰石樣品中碳酸鈣的質量分數,某學習小組進行了如下實驗探究,取10 g石灰石樣品放入燒杯中,加入稀鹽酸至不再產生氣泡為止(石灰石中的雜質不溶于水,也不反應),并繪制了加入稀鹽酸的質量與放出氣體質量的坐標圖(見圖).
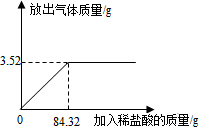
(1)碳酸鈣完全反應用去稀鹽酸的質量為________g.
(2)該石灰石樣品中碳酸鈣的質量分數為________.
(3)當鹽酸和石灰石恰好完全反應,所得溶液中溶質質量分數是多少?(規范寫出計算過程)
專題∶綜合計算(圖像型、表格型、情景型計算題).
分析∶(1)圖象的轉折點是二者恰好反應的點,觀察圖象可知此時用去稀鹽酸的質量為84.32 g;
(2)根據二氧化碳的質量可求出碳酸鈣的質量,最后根據![]() ×100%,可求出石灰石樣品中碳酸鈣的質量分數;
×100%,可求出石灰石樣品中碳酸鈣的質量分數;
(3)根據二氧化碳的質量可求出生成的氯化鈣的質量,所得溶液的質量=反應前各組份的質量之和-氣體的質量-雜質的質量,并據溶質的質量分數解答.
解答∶解∶(1)圖象的轉折點是二者恰好反應的點,觀察圖象可知此時用去稀鹽酸的質量為84.32 g;
(2)據圖象可知∶該樣品最多與鹽酸反應生成二氧化碳3.52 g;
設碳酸鈣的質量為x,生成的氯化鈣質量為y
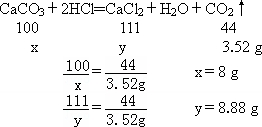
該石灰石樣品中碳酸鈣的質量分數=![]() ×100%=80%
×100%=80%
(3)反應后氯化鈣溶液的質量為∶84.32 g+10 g-3.52 g-(10 g-8 g)=88.8 g
所得溶液中溶質質量分數是∶![]() ×100%=10%
×100%=10%
故答案為∶(1)84.32;
(2)80%;
(3)所得溶液中溶質的質量分數為10%.
點評∶本題是一道關于圖象的題目,解答時注意分析圖象的起點、轉折點和終點及變化趨勢,尤其是轉折點通常是化學反應恰好完成的點;求反應后所得溶液的質量的質量分數是初中化學計算的一個重點和難點,計算反應后溶液的質量的方法一般是∶反應后溶液的質量=反應前各組份的質量之和-氣體的質量-沉淀(或雜質)的質量.
考點∶根據化學反應方程式的計算;有關溶質質量分數的簡單計算.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源:峨眉山市二模 題型:問答題
查看答案和解析>>
科目:初中化學 來源:期末題 題型:計算題
 )
) 查看答案和解析>>
科目:初中化學 來源:2010年四川省樂山市峨眉山市中考化學二模試卷(解析版) 題型:解答題
查看答案和解析>>
科目:初中化學 來源:2011年四川省樂山市峨眉山市中考化學二模試卷(解析版) 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com